Penerbitan baru
Mekanisme genetik baru boleh memberikan sasaran terapeutik terhadap glioma
Ulasan terakhir: 02.07.2025

Semua kandungan iLive disemak secara perubatan atau fakta diperiksa untuk memastikan ketepatan faktual sebanyak mungkin.
Kami mempunyai garis panduan sumber yang ketat dan hanya memautkan ke tapak media yang bereputasi, institusi penyelidikan akademik dan, apabila mungkin, dikaji semula kajian secara medis. Perhatikan bahawa nombor dalam kurungan ([1], [2], dan lain-lain) boleh diklik pautan ke kajian ini.
Jika anda merasakan bahawa mana-mana kandungan kami tidak tepat, ketinggalan zaman, atau tidak dipersoalkan, sila pilih dan tekan Ctrl + Enter.
Satu kajian daripada makmal Shi-Yuan Cheng, PhD, profesor di Bahagian Neuro-Onkologi Ken dan Ruth Davey di Jabatan Neurologi, telah mengenal pasti mekanisme baharu yang mendasari peristiwa penyambungan RNA alternatif dalam sel tumor glioma yang mungkin berfungsi sebagai sasaran terapeutik baharu. Hasil kajian diterbitkan dalam Journal of Clinical Investigation.
"Kami telah menemui cara yang berbeza untuk merawat glioma melalui lensa penyambungan alternatif dan menemui sasaran baharu yang belum dikenal pasti sebelum ini tetapi penting untuk keganasan glioma, " kata Xiao Song, MD, PhD, profesor neurologi bersekutu dan pengarang utama kajian itu.
Glioma adalah jenis tumor otak primer yang paling biasa pada orang dewasa dan berasal dari sel glial, yang berada dalam sistem saraf pusat dan menyokong neuron jiran. Glioma sangat tahan terhadap rawatan standard, termasuk radiasi dan kemoterapi, disebabkan oleh kepelbagaian genetik dan epigenetik tumor, yang menonjolkan keperluan untuk mencari sasaran terapeutik baharu.
Penyelidikan sebelumnya dari makmal Cheng, yang diterbitkan dalam jurnal Cancer Research, menunjukkan bahawa faktor penyambungan penting SRSF3 meningkat dengan ketara dalam glioma berbanding dengan otak biasa, dan penyambungan RNA yang dikawal oleh SRSF3 menggalakkan pertumbuhan dan perkembangan glioma dengan mempengaruhi pelbagai proses selular dalam sel tumor.
Penyambungan RNA ialah proses yang melibatkan penyingkiran intron (kawasan bukan pengekodan RNA) dan penyambungan ekson (kawasan pengekodan) untuk membentuk molekul mRNA matang yang menyokong ekspresi gen dalam sel.
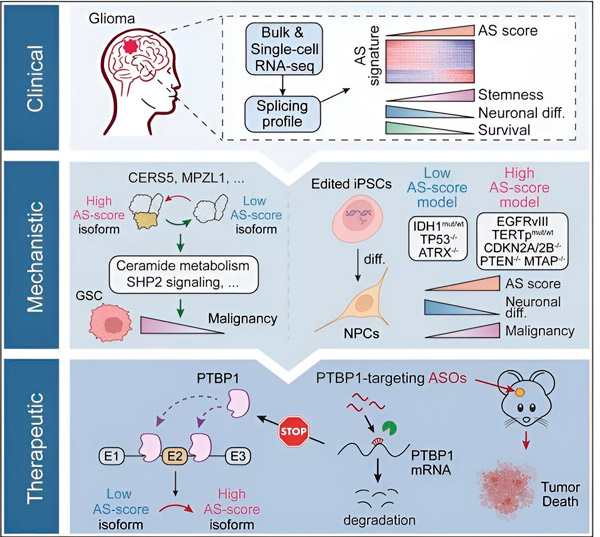
Dalam kajian ini, saintis bertujuan untuk mengenal pasti perubahan dalam penyambungan alternatif dalam sel tumor glioma, mekanisme yang mendasari perubahan ini, dan menentukan potensi mereka sebagai sasaran terapeutik.
Menggunakan kaedah pengiraan dan teknologi penjujukan RNA, para penyelidik meneliti perubahan splicing dalam sel tumor glioma daripada sampel pesakit. Untuk mengesahkan perubahan ini, mereka menggunakan teknologi penyuntingan gen CRISPR untuk memperkenalkan mutasi pemacu glioma yang berbeza ke dalam model glioma yang diperoleh daripada sel stem pluripotent (iPSC) yang disebabkan oleh manusia.
Mereka mendapati bahawa perubahan splicing ini dipertingkatkan oleh varian reseptor faktor pertumbuhan epidermis III (EGFRIII), yang diketahui terlalu tertekan dalam banyak tumor, termasuk glioma, dan dihalang oleh mutasi dalam gen IDH1.
Penyelidik telah mengesahkan fungsi dua peristiwa penyambungan RNA yang mencipta isoform protein berbeza dengan urutan asid amino yang berbeza.
"Hanya satu daripada isoform ini boleh menggalakkan pertumbuhan tumor, berbanding dengan isoform lain, yang biasanya dinyatakan dalam otak normal. Tumor mengeksploitasi mekanisme ini untuk secara selektif menyatakan isoform penggalak tumor berbanding isoform otak biasa," kata Song.
Pasukan itu kemudian menganalisis protein pengikat RNA hulu dan mendapati bahawa gen PTBP1 mengawal penyambungan RNA yang menggalakkan tumor dalam sel glioma. Menggunakan model glioma orthotopic dalam tikus immunodeficient, para penyelidik menyasarkan PTBP1 dengan terapi berasaskan antisense oligonucleotide (ASO), yang akhirnya menindas pertumbuhan tumor.
"Data kami menyerlahkan peranan splicing RNA alternatif dalam mempengaruhi keganasan dan heterogeniti glioma dan potensinya sebagai kelemahan terapeutik untuk rawatan glioma dewasa, " tulis penulis kajian.
Langkah seterusnya untuk penyelidik adalah untuk meneroka potensi menyasarkan PTBP1 untuk menimbulkan tindak balas imun anti-tumor, kata Song.
"Menggunakan analisis penjujukan RNA yang telah lama dibaca, kami mendapati bahawa menyasarkan PTBP1 dalam sel glioma menghasilkan pengeluaran pelbagai transkrip yang disambung secara alternatif yang tidak terdapat dalam tisu normal. Jadi projek seterusnya kami adalah untuk mengetahui sama ada isoform ini boleh menjana beberapa antigen supaya sistem imun dapat mengenali tumor dengan lebih baik, "kata Song.
Song juga menambah bahawa pasukan mereka berminat untuk menganalisis perubahan splicing dalam sel bukan tumor daripada pesakit glioma, seperti sel imun.
"Kami sudah tahu bahawa penyambungan adalah sangat penting untuk mengawal fungsi dalam sel, jadi ia bukan sahaja mengawal selia keganasan tumor, tetapi ia juga boleh mengawal selia fungsi sel imun untuk menentukan sama ada mereka boleh membunuh kanser dengan berkesan. Jadi kami juga melakukan beberapa analisis bioinformatik dalam sel imun yang disusupi tumor untuk melihat sama ada terdapat perubahan dalam penyambungan selepas sel imun telah menyusup ke tumor.
"Matlamat kami adalah untuk menentukan peranan penyambungan alternatif dalam membentuk persekitaran mikro tumor yang menindas imun dan mengenal pasti sasaran yang berpotensi untuk meningkatkan keberkesanan imunoterapi dalam glioma," kata Song.
