Penerbitan baru
Ubat LM11A-31 melambatkan perkembangan penyakit Alzheimer dalam percubaan
Ulasan terakhir: 02.07.2025

Semua kandungan iLive disemak secara perubatan atau fakta diperiksa untuk memastikan ketepatan faktual sebanyak mungkin.
Kami mempunyai garis panduan sumber yang ketat dan hanya memautkan ke tapak media yang bereputasi, institusi penyelidikan akademik dan, apabila mungkin, dikaji semula kajian secara medis. Perhatikan bahawa nombor dalam kurungan ([1], [2], dan lain-lain) boleh diklik pautan ke kajian ini.
Jika anda merasakan bahawa mana-mana kandungan kami tidak tepat, ketinggalan zaman, atau tidak dipersoalkan, sila pilih dan tekan Ctrl + Enter.

Dalam kajian baru-baru ini yang diterbitkan dalam jurnal Nature Medicine, saintis menjalankan kajian rawak, dua buta, terkawal fasa 2a plasebo untuk mengkaji keselamatan dan keberkesanan LM11A-31 dalam rawatan penyakit Alzheimer (AD) melalui modulasi reseptor neurotropin p75 (p75NTR).
AD onset lewat adalah bentuk demensia yang paling biasa, dicirikan oleh kegagalan sinaptik, degenerasi, dan kehilangan sel saraf. Walaupun dua ubat utama untuk rawatan AD menyasarkan pengumpulan protein amyloid-β atau tau yang tidak normal, mereka hanya menangani sebahagian daripada patofisiologi. Pendekatan lain melibatkan penyasaran reseptor dan rangkaian isyarat yang mempengaruhi laluan biologi asas. Kajian praklinikal menunjukkan bahawa modulasi p75NTR dengan molekul kimia kecil baru, LM11A-31, mengurangkan kehilangan sinaptik yang disebabkan oleh amiloid dan tau tidak normal.
Penerangan kajian
Dalam percubaan klinikal rawak ini, para penyelidik mengkaji sama ada LM11A-31 boleh memperlahankan perkembangan penyakit Alzheimer dengan memodulasi p75NTR pada manusia.
Peserta kajian diberi kapsul oral LM11A-31 pada dos 200 mg dan 400 mg atau plasebo dalam nisbah 1:1:1 kepada 242 pesakit dengan asma ringan hingga sederhana selama 26 minggu. Para peserta telah mengesahkan secara biologi penyakit Alzheimer (cecair serebrospinal amyloid β protein 42 (Aβ42) tahap di bawah 550 ng/L atau nisbah Aβ42:β40 di bawah 0.89) didiagnosis mengikut kriteria McKhann, dengan skor Mini-Psychiatric Examination (MMSE) 18 hingga 26, Skor Kemurungan S.G. skor Skala Iskemia Hachinski (HIS) yang diubah suai ≤ 4.0, pendidikan formal ≥ 8 tahun, dan penurunan kognitif sebelumnya ≥ 6 bulan.
Peserta yang layak telah mengambil perencat acetylcholinesterase (AChEIs) atau antagonis reseptor NMDA separa selama ≥ 3 bulan sebelum kemasukan kajian. Mereka tidak mengambil ubat terlarang seperti antipsikotik, benzodiazepin, ubat antiepileptik, sedatif, antihipertensi aktif berpusat, nootropik (kecuali ginkgo biloba), atau analgesik yang mengandungi opioid.
Hasil utama kajian adalah keselamatan dan toleransi, dinilai menggunakan Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), tanda-tanda vital, tekanan darah, dan parameter hematologi. Pengimejan resonans magnetik struktur (cMRI), tomografi pelepasan positron fluorodeoxyglucose (FDG-PET), dan biomarker cecair serebrospinal (CSF) digunakan untuk menilai hasil kognitif sekunder. Langkah AD termasuk tau Thr181-fosforilasi, jumlah protein tau, Aβ40, Aβ42, dan aktiviti AChE. Pasukan itu menggunakan ujian neuropsikologi tersuai untuk menilai hasil kognitif sekunder pada peringkat awal, minggu 12, dan 26.
Hasil penyelidikan
Kajian itu mendapati LM11A-31 selamat dan diterima dengan baik, tanpa kebimbangan keselamatan yang ketara. Kesan buruk yang paling biasa termasuk sakit kepala, cirit-birit, eosinofilia, dan nasofaringitis, dengan masalah gastrousus dan eosinofilia menjadi sebab utama untuk pemberhentian. Terdapat lebih banyak pemberhentian dalam kumpulan 400 mg berbanding dengan kumpulan 200 mg dan plasebo. MRI tidak mendedahkan kebimbangan keselamatan, termasuk keabnormalan berkaitan amiloid. Tidak terdapat perbezaan yang signifikan dalam skor kognitif atau keabnormalan amiloid antara kedua-dua kumpulan rawatan.
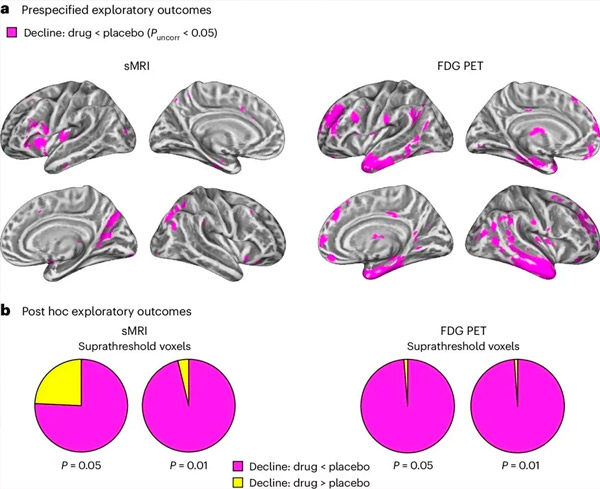
A. Analisis model campuran dua hala bagi kovarians mengkaji interaksi antara rawatan (ubat atau plasebo) dan masa (sebelum atau selepas rawatan). Kontras-t satu ekor yang memeriksa hipotesis interaksi (ubat melambatkan perkembangan berbanding dengan plasebo) menunjukkan bahawa rawatan LM11A-31 memperlahankan degenerasi membujur (panel kiri) dan hipometabolisme glukosa (panel kanan) dalam kumpulan ubat (cMRI, n = 127; PET, n = 121) (berbanding dengan kumpulan plasebo, n = 121) (berbanding dengan kumpulan plasebo, n = 6). Voxel yang menunjukkan interaksi ini ditunjukkan pada ambang tidak diperbetulkan P <0.05 (magenta) pada permukaan kortikal khusus populasi. Hemisfera kiri dan kanan ditunjukkan di baris atas dan bawah, masing-masing. Kawasan otak yang menunjukkan interaksi yang tidak konsisten dengan hipotesis ditunjukkan dalam Rajah 7 dalam Data Tambahan.
B. Jumlah bilangan voxel dalam kawasan otak AD terdedah yang dipratentukan (jumlah kawasan carta pai) menunjukkan sama ada interaksi sejajar dengan hipotesis (magenta) atau interaksi yang tidak konsisten dengan hipotesis (kuning) dalam setiap modaliti pengimejan (cMRI, panel kiri; FDG PET, panel kanan) pada ambang P.0.0 yang semakin liberal dan P.0.0 yang tidak betul Simulasi Monte Carlo menunjukkan bahawa nisbah voxel yang menunjukkan kesan sejajar dengan hipotesis berbanding tidak konsisten dengan hipotesis adalah jauh lebih tinggi daripada yang diperhatikan berdasarkan data yang dijana secara rawak untuk kedua-dua cMRI dan PET (P <0.001 untuk setiap modaliti; ujian dua hujung).
LM11A-31 berkesan mengurangkan peningkatan CSF Aβ42 dan Aβ40 berbanding kumpulan plasebo. Ubat ini juga menunjukkan pengurangan dalam perubahan peratusan tahunan median dalam biomarker protein presinaptik SNAP25 dan penurunan dalam biomarker postsynaptic NG, menunjukkan perlambatan kehilangan sambungan presinaptik dan postsynaptic. LM11A-31 juga mengurangkan peningkatan dalam YKL40, membawa kepada penurunan dalam skor MMSE dan peningkatan dalam skor ADAS-Cog-13. Ubat ini juga mengurangkan kehilangan bahan kelabu dalam lobus depan dan korteks parietal posterior dan penurunan metabolisme glukosa di kawasan seperti korteks entorhinal, korteks temporal, hippocampus, korteks insular, dan korteks prefrontal.
Kesimpulan
Kajian itu menyimpulkan bahawa modulasi p75NTR oleh LM11A-31 adalah sesuai untuk ujian klinikal yang lebih besar. LM11A-31 memenuhi titik akhir keselamatan utama dan diterima dengan baik pada pesakit dengan AD ringan hingga teruk. Keputusan menunjukkan keperluan untuk kajian lanjut dengan tempoh rawatan yang lebih lama untuk menilai potensi molekul kecil untuk mengawal p75NTR sebagai terapi pengubahsuaian penyakit dalam AD. Kajian menunjukkan bahawa LM11A-31 memberi kesan ketara kepada beberapa biomarker, termasuk Aβ40, Aβ42, SNAP25, NG, dan YKL40, yang menunjukkan perlambatan perkembangan patologi. Kajian masa depan mungkin menilai penunjuk tambahan kesihatan glial.
