Penerbitan baru
TIVDAK® yang diluluskan oleh FDA: Menyasarkan faktor tisu dalam kanser serviks
Ulasan terakhir: 02.07.2025

Semua kandungan iLive disemak secara perubatan atau fakta diperiksa untuk memastikan ketepatan faktual sebanyak mungkin.
Kami mempunyai garis panduan sumber yang ketat dan hanya memautkan ke tapak media yang bereputasi, institusi penyelidikan akademik dan, apabila mungkin, dikaji semula kajian secara medis. Perhatikan bahawa nombor dalam kurungan ([1], [2], dan lain-lain) boleh diklik pautan ke kajian ini.
Jika anda merasakan bahawa mana-mana kandungan kami tidak tepat, ketinggalan zaman, atau tidak dipersoalkan, sila pilih dan tekan Ctrl + Enter.
Pada 29 April 2024, Pentadbiran Makanan dan Ubat-ubatan (FDA) AS memberikan kelulusan penuh kepada TIVDAK® (tisotumab vedotin) Seagen Inc., ubat sasaran faktor tisu (TF), untuk rawatan pesakit dengan kanser serviks berulang atau metastatik yang telah berkembang semasa atau selepas kemoterapi. Ini mewakili satu kejayaan besar dalam terapi kanser serviks, menonjolkan potensi konjugat ubat antibodi (ADC) dalam onkologi.
Mekanisme tindakan TIVDAK
Tivdak ialah ADC yang menyasarkan TF dengan menggabungkan tisotumab antibodi monoklonal anti-TF Genmab dengan teknologi ADC Seagen yang direka untuk menyasarkan antigen TF pada sel kanser dan menghantar komponen sitotoksik MMAE terus kepada sel kanser.
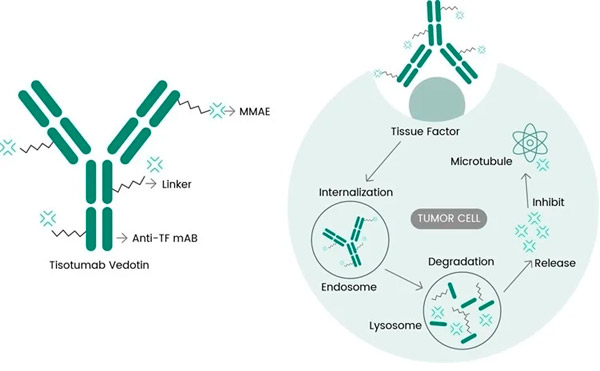
Mekanisme molekul tindakan tisotumab vedotin ( https://doi.org/10.3390/ijms23073559 )
TF: Sasaran Sempurna untuk Pembangunan ADC
TF diketahui terlibat dalam isyarat tumor dan angiogenesis dan terlalu tertekan dalam kebanyakan pesakit dengan kanser serviks dan banyak tumor pepejal lain. Keupayaannya untuk dihayati dengan cepat semasa pengikatan antibodi dan kesan minimumnya terhadap pembekuan darah normal meningkatkan lagi kesesuaiannya untuk terapi kanser yang disasarkan.
