Pakar perubatan artikel itu
Penerbitan baru
Rabies pada kanak-kanak
Ulasan terakhir: 04.07.2025

Semua kandungan iLive disemak secara perubatan atau fakta diperiksa untuk memastikan ketepatan faktual sebanyak mungkin.
Kami mempunyai garis panduan sumber yang ketat dan hanya memautkan ke tapak media yang bereputasi, institusi penyelidikan akademik dan, apabila mungkin, dikaji semula kajian secara medis. Perhatikan bahawa nombor dalam kurungan ([1], [2], dan lain-lain) boleh diklik pautan ke kajian ini.
Jika anda merasakan bahawa mana-mana kandungan kami tidak tepat, ketinggalan zaman, atau tidak dipersoalkan, sila pilih dan tekan Ctrl + Enter.
Rabies, atau hidrofobia, adalah penyakit virus akut yang disebarkan melalui gigitan haiwan yang dijangkiti, dengan kerosakan pada sistem saraf dan perkembangan ensefalitis yang teruk dengan hasil yang membawa maut.
Epidemiologi
Serangan kesihatan awam sejak zaman purba, virus rabies pada masa ini menyebabkan kira-kira 59,000 kematian manusia setiap tahun, hampir kesemuanya berjangkit melalui gigitan anjing. Ini mempunyai kesan ekonomi yang ketara ke atas negara membangun, khususnya di Afrika dan Asia, yang boleh menanggung paling sedikit kerugian tersebut. Walau bagaimanapun, walaupun kadar kematiannya hampir 100%, rabies anjing adalah penyakit yang boleh dicegah sepenuhnya, dan contoh sejarah pembasmian anjing gila di negara maju membuktikannya. [ 1 ]
Punca rabies
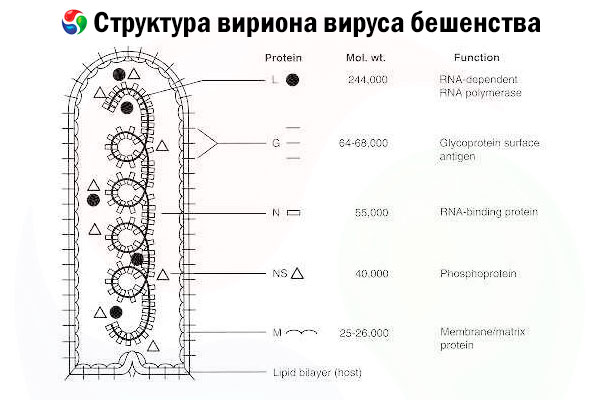
Ejen penyebabnya ialah virus rabies (RV), virus RNA untai negatif daripada keluarga rhabdovirus, bersaiz kira-kira 60 nm × 180 nm.
Ia terdiri daripada teras protein dalam, atau nukleokapsid, yang mengandungi asid nukleik, dan membran luar, dwilapisan yang mengandungi lipid yang diliputi dengan pancang glikoprotein transmembran. Ia mempunyai struktur genom modular yang agak mudah dan mengekodkan lima protein struktur:
- RNA polimerase (L) yang bergantung kepada RNA
- nukleoprotein (N),
- protein terfosforilasi (P),
- protein matriks (M) dan
- glikoprotein permukaan luar (G).
Protein N, P, dan L bersama-sama dengan RNA genom membentuk kompleks ribonukleoprotein. G ialah satu-satunya antigen RV yang mampu mendorong pengeluaran antibodi peneutral RV, yang merupakan pengesan imun utama terhadap jangkitan RV yang boleh membawa maut. Sebaliknya, kompleks ribonukleoprotein telah ditunjukkan sebagai antigen RV utama yang mampu mendorong sel T CD4+, yang boleh meningkatkan pengeluaran antibodi peneutral RV melalui pengecaman antigen intrastruktur.[ 2 ] Kompleks ribonukleoprotein mungkin memainkan peranan penting dalam pembentukan memori imunologi dan imuniti jangka panjang ].
Klasifikasi dan jenis antigen
Genus Lyssavirus termasuk virus rabies dan virus rabies yang berkaitan dengan antigen dan genetik: Lagos, Mokola, dan virus kelawar Duvenhage, serta dua subtipe yang diduga lyssavirus kelawar Eropah. Kajian perlindungan silang menunjukkan bahawa haiwan yang diimunisasi dengan vaksin rabies tradisional mungkin tidak dilindungi sepenuhnya apabila dicabar dengan lyssavirus lain.
Virus Rabies boleh dikelaskan sebagai tetap (diadaptasi mengikut laluan dalam haiwan atau kultur sel) atau jalanan (jenis liar). Penggunaan antibodi monoklonal dan penjujukan genetik untuk membezakan virus rabies jalanan telah membantu dalam mengenal pasti varian virus yang berasal dari takungan perumah utama di seluruh dunia dan dalam mencadangkan kemungkinan sumber pendedahan manusia apabila sejarah gigitan haiwan yang muktamad sebaliknya tiada dalam kes pesakit.[ 8 ]
Patogenesis
Takungan utama dan sumber jangkitan di kalangan haiwan liar ialah serigala, musang, serigala, kelawar, dan di kalangan haiwan domestik - anjing dan kucing, jarang - kuda, lembu, babi, tikus, dll. Penghantaran jangkitan dari orang ke orang, walaupun mungkin, sangat jarang berlaku. Ini adalah jangkitan zoonosis biasa. Orang ramai dijangkiti rabies terutamanya daripada anjing.
Selepas manusia digigit oleh haiwan yang sakit, virus itu membiak dalam tisu otot di tapak gigitan, dan kemudian, setelah mencapai hujung saraf periferi deria, merebak secara sentripetal, mencapai neuron motor. Masa yang diperlukan untuk virus bergerak dan otak terjejas bergantung pada tapak gigitan. Sekiranya gigitan teruk pada kepala dan muka, virus boleh mencapai sistem saraf pusat dalam 15-20 hari, dan sekiranya berlaku kerosakan kecil pada kulit batang dan anggota badan dan, akibatnya, dos kecil patogen, proses pemindahan virus ke sistem saraf pusat boleh ditangguhkan selama beberapa bulan atau bahkan sehingga 1-1.5 tahun. Setelah mencapai sistem saraf pusat, virus itu terpaku dalam tisu otak dan saraf tunjang, terutamanya dalam neuron medulla oblongata, tanduk Ammon, dan pangkal otak. Dalam saraf tunjang, tanduk posterior paling terjejas. Dari sistem saraf pusat, virus secara sentrifugal di sepanjang batang saraf mencapai kelenjar air liur, di mana ia membiak dan dikumuhkan dengan air liur.
Konsep dalam patogenesis rabies
RV mempunyai julat perumah yang luas dan boleh menjangkiti hampir semua mamalia. Walaupun beberapa laluan penghantaran RV telah dilaporkan, jangkitan semula jadi paling kerap berlaku melalui gigitan. Selain gigitan, pengambilan bangkai yang dijangkiti RV boleh menggalakkan jangkitan virus rabies pada musang Artik, dan sentuhan RV dengan membran mukus didapati sebagai satu lagi laluan penularan yang mungkin.[ 9 ] Dalam beberapa keadaan luar biasa, seperti pelepasan RV secara tidak sengaja sebagai aerosol dalam makmal atau RV sebagai babitt, dalam jumlah besar penghantaran di dalam gua[ 10 ] mungkin berlaku.
Masih belum jelas sama ada strain RV yang disesuaikan dengan RV jalanan dan tetikus atau yang disesuaikan dengan kultur tisu mereplikasi di tapak inokulasi sebelum ia memasuki CNS. Sementara jangkitan intramuskular eksperimen hamster juvana atau raccoon dengan RV jalanan mendedahkan replikasi RV dalam sel otot berjalur sebelum virus menyerang akson neuron motor merentasi persimpangan neuromuskular, [ 11 ], [ 12] jangkitan intramuskular tikus dengan CVS-24 RV yang disesuaikan dengan tetikus menunjukkan bahawa RV tanpa replikasi di tapak C3 telah berhijrah secara langsung. dalam terminal akson yang tidak bermielin, RV diangkut secara retrograd ke badan sel.
Penemuan terkini mencadangkan bahawa pengangkutan vesikel axonal mungkin mewakili strategi utama untuk pergerakan virion jarak jauh dalam akson.[ 14 ] Telah dianggarkan bahawa RV berhijrah dalam akson pada kadar 3 mm/j.[ 15 ] Jangkitan kemudiannya merebak melalui rantaian neuron yang disambungkan oleh persimpangan sinaptik. Walau bagaimanapun, mekanisme tepat yang menggalakkan penyebaran transsynaptic masih tidak diketahui. Selepas menjangkiti otak, virus merebak secara emparan ke sistem saraf periferi dan autonomi dalam banyak organ periferi.[ 16 ] Pada peringkat terakhir kitaran jangkitan, RV berhijrah ke kelenjar air liur; selepas replikasi dalam sel asinar mukogenik, ia dilepaskan ke dalam air liur dan sedia untuk dihantar ke perumah seterusnya.[ 17 ]
Berkenaan dengan patologi yang disebabkan oleh virus rabies, kematian sel apoptosis telah dicadangkan sebagai mekanisme patogenik yang berpotensi dalam model eksperimen rabies tikus yang dijangkiti dengan strain tetap RV.[ 18 ] Mekanisme patogenik yang boleh menyumbang kepada ciri disfungsi CNS yang mendalam bagi rabies mungkin mengalami gangguan fungsi neuron. Ekspresi gen telah ditunjukkan berkurangan dengan ketara dalam neuron yang dijangkiti RV, mengakibatkan penindasan umum sintesis protein, [ 19 ] dan beberapa kajian telah menunjukkan gangguan neurotransmisi berikutan jangkitan RV. Jiang menunjukkan bahawa pengikatan antagonis reseptor asetilkolin kepada homogenat otak tikus yang dijangkiti telah dikurangkan berbanding dengan kawalan.[ 20 ] Pelepasan dan pengikatan serotonin terjejas, neurotransmitter yang terlibat dalam kawalan kitaran tidur, persepsi kesakitan, dan tingkah laku, juga diperhatikan dalam otak tikus yang dijangkiti RV. [ 21 ], [ 22 ] Selain menjejaskan penghantaran saraf, jangkitan ventrikel kanan juga boleh menjejaskan saluran ion. Sel neuroblastoma tetikus yang dijangkiti mempamerkan penurunan fungsi saluran natrium berpagar voltan, yang mungkin menghalang potensi tindakan dan akhirnya membawa kepada kemerosotan fungsi. [ 23 ]
Sebagai tambahan kepada ketiadaan lesi patologi yang serius dalam CNS, kebanyakan kes rabies manusia tidak menimbulkan tindak balas imun 7 hingga 10 hari selepas permulaan tanda-tanda klinikal. Perbezaan mendalam antara patogenesis rabies dan kebanyakan jangkitan CNS virus atau bakteria lain disokong lagi oleh fakta bahawa imunosupresi sama ada tidak berkesan atau memudaratkan hasil rabies.[ 24 ] Tahap tindak balas imun yang rendah yang sering diperhatikan pada mangsa rabies adalah membingungkan kerana ia tidak dapat dijelaskan oleh imunogenisitas antigen RV yang lemah. Malah, protein RV G dan nukleokapsid adalah antigen sel B dan T yang kuat apabila diberikan secara parenteral. [ 25 ] Penjelasan yang mungkin untuk tahap rendah tindak balas imun terhadap RV pada manusia atau haiwan dengan rabies mungkin bahawa jangkitan RV pada CNS menyebabkan imunosupresi, [ 26 ] dan telah dicadangkan bahawa RV menggunakan strategi subversif termasuk mencegah apoptosis dan memusnahkan sel T yang menyerang. [ 27 ]
Strain RV yang dilemahkan yang telah disesuaikan dengan sel bukan neuron berbeza dengan ketara daripada strain RV jalanan patogenik dalam neuroinvasiveness mereka, yang merujuk kepada keupayaan mereka untuk menyerang CNS dari tapak persisian. Dalam hal ini, strain RV yang disesuaikan dengan kultur tisu sama ada kekurangan atau hanya mempunyai keupayaan terhad untuk menyerang CNS dari tapak persisian, manakala strain RV jalanan atau strain RV yang disesuaikan dengan tetikus seperti CVS-24 adalah sangat invasif.[ 28 ] Faktor utama yang terlibat dalam neuroinvasion RV termasuk pengambilan virus, pengangkutan akson, kadar replikasi trans-sinaptik, dan penyebaran replikasi virus.
Sehingga baru-baru ini, pengetahuan kami tentang patogenesis RV adalah terhad dan berdasarkan terutamanya pada kajian deskriptif tentang strain RV jalanan atau jangkitan eksperimen dengan strain yang dilemahkan yang disesuaikan di makmal. Kemunculan teknologi genetik songsang telah membolehkan kami mengenal pasti unsur virus yang menentukan fenotip patogen RV dan untuk lebih memahami mekanisme yang terlibat dalam patogenesis rabies.
Pengenalpastian unsur virus yang mengawal pemerolehan, penyebaran dan replikasi virus rabies
- Unsur virus yang terlibat dalam penangkapan virus
Jangkitan RV bermula dengan perlekatan virus pada reseptor selular yang diduga. Walaupun beberapa molekul permukaan membran telah dicadangkan sebagai reseptor RV, termasuk reseptor asetilkolin nikotinik, [ 29 ] molekul lekatan sel saraf [ 30 ] dan reseptor neurotropin pertalian rendah p75 NTR, [ 31 ] masih tidak jelas sama ada molekul ini sebenarnya memainkan peranan dalam kitaran hayat virus rabies. Dalam konteks ini, baru-baru ini telah ditunjukkan bahawa interaksi RV G–p75 NTR tidak diperlukan untuk jangkitan RV neuron primer.[ 32 ] Berikutan pengikatan reseptor, RV dihayati melalui endositosis adsorptif atau pengantara reseptor. [ 33 ] Persekitaran pH yang rendah dalam petak endosom kemudian mendorong perubahan konformasi dalam RV G yang mencetuskan percantuman membran virus dengan membran endosom, dengan itu melepaskan RNP ke dalam sitoplasma. [ 34 ] Bagi virus, RV G memainkan peranan penting dalam pengambilan virus, kemungkinan besar melalui interaksi dengan reseptor selular yang diduga yang memudahkan pengambilan pantas. Dalam hal ini, telah ditunjukkan bahawa kepatogenan strain RV yang disesuaikan dengan kultur tisu (cth, ERA, HEP, dan CVS-11) berkorelasi dengan kehadiran penentu yang terletak di tapak antigenik III protein G. [ 35 ] Mutasi Arg → Gln pada kedudukan 333 dalam tapak antigenik protein ERA G ini mengakibatkan kelewatan tujuh kali ganda dalam internalisasi varian Gln333 RV berbanding dengan varian jenis liar. Mutasi Asn194→Lys194 dalam RV G, yang menerangkan kemunculan semula fenotip patogenik, dikaitkan dengan penurunan ketara dalam masa internalisasi.[ 36 ] Tambahan pula, eksperimen dengan RV chimeric menunjukkan bahawa masa yang diperlukan untuk internalisasi virion RV telah meningkat dengan ketara, dan patogeniknya telah dikurangkan dengan kuat oleh gen RV patogenik penggantian GSB yang sangat dikurangkan. daripada klon cDNA bagi strain berkaitan kelawar RV-18,[ 37 ] yang berasal dari perak dengan strain SN yang sangat dilemahkan, yang diasingkan daripada klon cDNA bagi strain vaksin SAD B19 RV.[ 38 ] Bersama-sama, data ini menyokong tanggapan bahawa kinetik RV, yang merupakan fungsi penentuan virus RV, adalah penentuan RV. sifat patogenik.
- Elemen virus yang terlibat dalam penyebaran dan penghantaran virus
Sifat unik virus rabies adalah keupayaannya untuk merebak dari sel ke sel. Pemerhatian bahawa varian Gln333 ERA kehilangan aktiviti gabungan sel-sel yang bergantung kepada pH secara in vitro [ 39 ] dan memaparkan keupayaan yang sangat berkurangan untuk merebak dari sel ke sel [ 40 ] menunjukkan bahawa RV G juga memainkan peranan penting dalam penyebaran sel-ke-sel dan seterusnya penghantaran virus, mungkin melalui aktiviti fusiogeniknya. Kemungkinan ini disokong lagi oleh penemuan bahawa kadar penyebaran SPBNGAK pembalikan RV patogenik adalah hampir dua kali lebih tinggi daripada yang ditentukan untuk varian SPBNGA bukan patogen. Menariknya, mutasi Asn 194 → Lys 194 dalam G SPBNGAK menyebabkan peralihan dalam ambang pH untuk pelakuran membran kepada pH yang lebih tinggi, menyokong hipotesis bahawa ambang pH yang lebih tinggi untuk gabungan membran dikaitkan dengan peningkatan penyebaran virus. [ 41 ]
Kajian penunjuk transneuronal jangkitan RV pada tikus [ 42 ] dan monyet rhesus [ 43 ] telah menunjukkan bahawa virus rabies berhijrah secara eksklusif dalam arah retrograde dalam akson. Walaupun beberapa protein RV terlibat dalam mekanisme pengangkutan neuron, RV G nampaknya memainkan peranan utama dalam penyebaran transneuronal jangkitan RV. Contohnya, sementara jangkitan periferi dengan virus anemia berjangkit kuda (EIAV) pseudotaip dengan RV G mengakibatkan pemindahan virus ke saraf tunjang, pseudotaip EIAV yang sama dengan virus stomatitis vesikular G gagal memasuki sistem saraf. [ 44 ] Tambahan pula, penyebaran virus mutan ERA G Arg 333 → Gln 333 dalam CNS didapati sangat berkurangan berbanding dengan mutan jenis liar, seterusnya mencadangkan fungsi RV G utuh dalam penyebaran trans-sinaptik. Walau bagaimanapun, bukti yang paling meyakinkan untuk peranan penting RV G dalam pengangkutan trans-sinaptik datang daripada jangkitan intrakranial tikus dengan virus RV kekurangan G rekombinan, yang menunjukkan bahawa jangkitan itu kekal terhad kepada neuron di tapak inokulasi tanpa sebarang bukti penyebaran ke neuron sekunder.[ 45 ] Walau bagaimanapun, berkemungkinan bahawa sebagai tambahan kepada virus RV transnaptic dan RV G, terdapat kemungkinan bahawa sebagai tambahan kepada RV dan virus transnaptic, peranan RV dalam penyebaran dan G, pengangkutan. Dalam hal ini, ditunjukkan bahawa penyebaran varian RV SN-BMBG chimeric, yang mengandungi kedua-dua M dan G dari SB yang sangat patogenik, adalah jauh lebih tinggi daripada penyebaran varian SN-BG atau SN-BM chimeric, yang masing-masing mengandungi G dan M dari SB, menunjukkan bahawa interaksi optimum M dengan G mungkin memainkan peranan penting dalam penyebaran virus sel ke sel. [ 46 ] Memandangkan RV M menyokong tunas virus, [ 47 ] berkemungkinan penyebaran varian chimeric RV SN-BMBG yang lebih cekap adalah disebabkan oleh tunas virus yang optimum pada membran pascasinaptik.
Kajian terkini menunjukkan bahawa interaksi antara RV P dan rantai cahaya dynein menghubungkan RV RNP ke sistem pengangkutan sel perumah, dengan itu memudahkan pengangkutan akson retrograde virus.[ 48 ],[ 49 ] Walau bagaimanapun, jangkitan periferi tikus dewasa menunjukkan bahawa pemadaman domain pengikatan LC8 RV PNS tidak menghalang kemasukan protein retrograde ke dalam CNS secara langsung. penyebaran RV.[ 50 ]
- Unsur virus yang mengawal replikasi virus
Tidak seperti kebanyakan virus lain, seperti virus influenza, patogenik RV adalah berkadar songsang dengan kadar sintesis RNA virus dan pengeluaran zarah virus berjangkit. Perbandingan tahap mRNA virus dan RNA genomik yang dihasilkan oleh virus chimeric yang berbeza menunjukkan bahawa transkripsi dan replikasi RNA virus dikawal oleh pelbagai faktor, termasuk RV M, yang telah dikenal pasti sebagai faktor trans-acting yang mengantara peralihan daripada tahap awal sintesis mRNA yang tinggi kepada sintesis RNA genomik.[ 51 ] Tambahan pula, M daripada semua rhabdovirus boleh mematikan virus kepada ekspresi rhabdonding virus yang mampu, pengantaraan genomik. mengakibatkan pembentukan struktur seperti tulang belakang yang sangat pekat yang tidak dapat menyokong sintesis RNA.
Untuk mengenal pasti unsur-unsur virus lain yang mengawal patogenik dengan mengawal replikasi virus, jujukan terminal 5' bagi strain SB yang sangat patogenik digantikan secara berperingkat dengan urutan daripada strain vaksin SN yang sangat dilemahkan, menghasilkan virus rekombinan SB2 (jujukan terminal [TS] + L), SB3 (TS + L + pseudogene [4Ψ]), SB3 + L + pseudogene [4Ψ], SB3 (TS + L + pseudogene [4Ψ]) (TS + L + Ψ + G + M). Jangkitan intramuskular dengan virus SB dan SN ibu bapa dan RV chimeric SB2, SB3, SB4, dan SB5 menimbulkan kadar kematian tertinggi dalam tikus yang dijangkiti SB dan tiada morbiditi atau kematian dalam tikus yang dijangkiti SN. Penggantian TS, L, dan SB dengan unsur-unsur yang sepadan daripada SN menghasilkan pengurangan sederhana dalam morbiditi dan mortaliti, dan pertukaran G atau G tambah M tambahan dengan kuat mengurangkan atau menghapuskan patogenik virus sepenuhnya.
Pencirian fenotip bagi RV jenis liar dan chimeric ini dalam kultur tisu mendedahkan bahawa patogenik RV yang diberikan adalah berkorelasi songsang dengan keupayaannya untuk mereplikasi dalam sel neuron. Walaupun SB direplikasi pada tahap hampir 1000 kali ganda lebih rendah daripada SN, dan penggantian TS, L, dan dalam SB oleh tahap SN mempunyai sedikit kesan ke atas kinetik pertumbuhan virus, penggantian tambahan G atau G tambah M SB oleh gen SN yang sepadan menghasilkan peningkatan 1 log dalam pengeluaran virus, menunjukkan bahawa kinetik replikasi RNA virus sebahagian besarnya adalah kinetik protein GV yang dikawal. Kesimpulan ini disokong oleh data yang diperoleh dengan varian RV G yang berbeza dengan satu asid amino dalam protein G mereka. Varian virus rabies patogenik SPBNGAK 194 menghasilkan titer virus dalam sel NA yang 1 log lebih rendah daripada yang dihasilkan oleh varian bukan patogenik SPBNGAN 194, dan analisis PCR masa nyata menunjukkan bahawa kadar transkripsi dan replikasi RNA virus dalam sel NA yang dijangkiti SPBNGAK adalah 5- dan 10 kali ganda NAK yang dijangkiti lebih tinggi daripada dalam SPBNGAK 5 kali ganda. korelasi songsang antara patogenik dan kadar sintesis RNA virus dan pengeluaran zarah virus telah disediakan oleh tikus yang dijangkiti virus rekombinan chimeric di mana gen G dan M daripada strain SN yang dilemahkan digantikan oleh strain SB yang sangat patogenik. Eksperimen ini mendedahkan peningkatan ketara dalam patogenik strain SN ibu bapa yang membawa RV G ke atas strain SB patogenik. Patogenisiti meningkat lagi apabila kedua-dua G dan M daripada SB diperkenalkan ke dalam SN.
Penggantian G atau M atau kedua-duanya dalam SN dengan gen yang sepadan daripada SB dikaitkan dengan penurunan ketara dalam kadar pengeluaran zarah virus serta kadar sintesis RNA virus. Data ini menunjukkan bahawa kedua-dua G dan M memainkan peranan penting dalam patogenesis RV dengan mengawal selia replikasi virus. Penemuan bahawa penggantian G atau G tambah M dalam SN dengan G atau G tambah M SB menghasilkan penurunan yang sederhana hingga kuat dalam transkripsi dan replikasi RNA virus, masing-masing, manakala penggantian M sahaja dalam SN dengan M daripada SB menghasilkan peningkatan yang kuat dalam transkripsi dan replikasi RNA virus, menunjukkan bahawa RV G juga mempunyai fungsi pengawalseliaan yang penting dalam transkripsi RNA virus sama ada secara bersendirian atau melalui interaksi RNA virus. Mekanisme yang mana gen RV G mengawal sintesis RNA virus tidak diketahui. Urutan nukleotida tertentu dalam gen RV G, seperti yang termasuk kodon untuk Arg333 dan Lys 194, telah dikenal pasti sebagai sasaran untuk miRNA selular. Telah ditunjukkan bahawa pengecaman sasaran oleh miRNA selular boleh mengakibatkan peraturan positif atau negatif replikasi virus. [ 53 ] Arg 333 → Glu 333 atau Lys 194 → Penggantian Ser 194 dalam jujukan gen RV G mengakibatkan pemansuhan jujukan sasaran miRNA, yang seterusnya dikaitkan dengan peningkatan ketara dalam kadar sintesis RNA virus [Faber M, Thomas Jefferson University, PA, Amerika Syarikat, mencadangkan peranan penting sebagai hos miRNA sebagai hos data selular yang tidak diterbitkan] Replikasi RV, seperti yang telah ditunjukkan untuk virus RNA lain termasuk virus stomatitis vesikular dan HCV. [ 54 ], [ 55 ]
Peraturan replikasi virus nampaknya merupakan salah satu mekanisme penting yang terlibat dalam patogenesis RV. Untuk mengelakkan tindak balas imun dan memelihara integriti rangkaian neuron, strain RV patogenik, tetapi bukan strain yang dilemahkan, boleh mengawal kadar pertumbuhannya. Kadar replikasi yang lebih rendah mungkin memberi manfaat kepada strain RV patogen dengan memelihara struktur neuron yang digunakan oleh virus ini untuk mencapai CNS. Penjelasan lain untuk kadar replikasi RV patogenik yang lebih rendah ialah, untuk mengelakkan pengesanan awal oleh sistem imun hos, virus mengekalkan tahap ekspresi minimum antigennya.
Hubungan antara ekspresi RV G, apoptosis dan patogenik
Adalah diketahui umum bahawa strain virus rabies jalanan yang jauh lebih patogenik daripada strain yang disesuaikan dengan kultur tisu mengekspresikan tahap G yang sangat terhad dan tidak mendorong apoptosis sehingga lewat dalam kitaran berjangkit, menunjukkan bahawa kepatogenan strain virus tertentu adalah berkorelasi songsang dengan ekspresi RV G dan keupayaan untuk mendorong apoptosis antara 56 ] Bukti langsung bagi tahap apoptosis dan ekspresi yang diperolehi adalah tahap corretosis. rekombinan RV SPBNGA-GA, yang membawa dua gen G yang sama dan RV G yang terlalu tertekan.[ 57 ] Kajian morfologi kultur neuron yang dijangkiti RV rekombinan ini menunjukkan bahawa kematian sel meningkat dengan ketara selari dengan ekspresi berlebihan RV G dan apoptosis adalah mekanisme utama yang terlibat dalam kematian pengantara RV G. Khususnya, penurunan pewarnaan F-aktin selepas jangkitan SPBNGA-GA adalah konsisten dengan penyahpolimeran filamen aktin yang disebabkan oleh apoptosis. Tambahan pula, bilangan nukleus TUNEL-positif dalam neuron yang dijangkiti SPBNGA-GA telah meningkat dengan ketara berbanding dengan neuron yang tidak dijangkiti dan dijangkiti SPBNGA. Walau bagaimanapun, mekanisme yang mana gen RV G mengantara proses isyarat apoptosis sebahagian besarnya masih tidak diketahui. Telah dicadangkan bahawa ekspresi RV G di atas ambang tertentu mengganggu membran sel dengan teruk. Kemungkinan besar sel apoptosis tidak dibersihkan dengan cepat dalam CNS dan oleh itu mengalami nekrosis sekunder. [ 58 ] Sebaliknya, jangkitan RV dan khususnya ekspresi berlebihan protein RV G boleh membawa kepada pyroptosis, laluan kematian sel yang serupa dengan apoptosis yang, tidak seperti apoptosis, melibatkan pengaktifan caspase 1 dan dengan itu membawa kepada nekrosis. [ 59 ] Tahap nekrosis atau pyroptosis yang disebabkan oleh jangkitan RV berkemungkinan memainkan peranan penting dalam induksi imuniti antivirus. Walaupun sel apoptosis mengekalkan integriti membran mereka dan tidak merangsang tindak balas imun semula jadi, sel nekrotik menjadi telap dan merembeskan adjuvant endogen yang boleh mencetuskan tindak balas imun semula jadi yang teguh. [ 60 ]
Memandangkan tahap apoptosis/nekrosis berkorelasi dengan imunogenisiti RV, telah dicadangkan bahawa kesan imunostimulasi sel apoptosis/nekrosis berkemungkinan besar menyumbang kepada penjanaan tindak balas imun pelindung. Oleh itu, pengawalseliaan ekspresi RV G berkemungkinan besar merupakan faktor penting dalam patogenesis rabies, kerana ia menyediakan cara untuk kelangsungan hidup dan penyebaran varian RV patogenik dalam sistem saraf tanpa menyebabkan kerosakan neuron yang terang-terangan dan menimbulkan tindak balas imun pelindung yang akan menghalang jangkitan.
Ekspresi RV G boleh dikawal pada tahap sintesis RNA, tahap pasca terjemahan, atau kedua-duanya. Tahap RV G yang dinyatakan oleh varian chimeric RV yang berbeza telah ditunjukkan untuk dicerminkan oleh kadar sintesis RNA virus, menunjukkan bahawa peraturan pembezaan ekspresi RV G oleh varian ini terhasil daripada variasi dalam kadar transkripsi mRNA virus. Seperti kadar transkripsi RNA virus, jumlah RV G yang dinyatakan oleh varian ini berkorelasi songsang dengan patogenik virus. Sebaliknya, jangkitan kultur neuron primer dengan varian RV CVS-B2c yang kurang patogenik menghasilkan empat kali ganda tahap protein G yang lebih tinggi daripada jangkitan dengan varian CVS-N2c yang sangat patogenik, walaupun terdapat sintesis tahap setanding G mRNA dalam kedua-dua jangkitan. Eksperimen pengejaran nadi menunjukkan bahawa tahap protein G yang lebih tinggi dalam neuron yang dijangkiti CVS-B2c sebahagian besarnya adalah hasil daripada kadar degradasi protein CVS-B2c G yang lebih rendah berbanding protein CVS-N2c G. Walau bagaimanapun, mekanisme yang membawa kepada degradasi proteolitik yang lebih pantas bagi protein CVS-N2c G masih belum dijelaskan.
Gejala rabies
Tempoh inkubasi untuk rabies adalah secara purata 30-90 hari. Dalam kes jangkitan besar-besaran melalui luka besar di kepala dan muka, ia boleh dipendekkan kepada 12 hari. Dalam kes yang jarang berlaku, tempoh inkubasi boleh bertahan 1 tahun atau lebih.
Terdapat perubahan berurutan yang ketat dari tiga tempoh penyakit: prodromal, pengujaan, lumpuh.
Tempoh prodromal bermula dengan kemunculan sakit atau sakit menarik di tapak gigitan, serta sakit di sepanjang saraf. Di kawasan parut, mungkin terdapat sensasi terbakar, gatal-gatal, kadang-kadang kemerahan dan bengkak. Pesakit mengalami malaise umum, sakit kepala, loya. Muntah-muntah, peningkatan suhu badan kepada 37.5-38 ° C dan gejala gangguan mental yang progresif diperhatikan: peningkatan keterujaan refleks, perasaan kebimbangan yang tidak dapat dijelaskan, ketakutan, kemurungan. Selalunya pesakit tertekan, terhalang, menarik diri, enggan makan, tidur dengan nyenyak, mengadu tentang pemikiran yang suram, mimpi yang menakutkan. Tempoh prodromal berlangsung 2-3 hari, kadang-kadang berlanjutan hingga 7 hari. Pada akhir tempoh ini, mungkin terdapat serangan kebimbangan dengan kesukaran bernafas jangka pendek, rasa sesak di dada, disertai dengan takikardia dan peningkatan kadar pernafasan.
Tempoh keseronokan ditandakan dengan kemunculan hidrofobia: apabila cuba minum, dan kemudian apabila melihat air atau peringatan tentangnya, pesakit mengalami kekejangan faring dan laring, di mana dia membuang cawan air dengan jeritan, melemparkan tangan yang gemetar ke hadapan, melemparkan kepala dan badannya ke belakang. Leher diregangkan, senyuman yang menyakitkan memutarbelitkan muka, yang menjadi kebiruan akibat kekejangan otot pernafasan. Mata terbeliak, menyatakan ketakutan, meminta pertolongan, anak mata mengembang, menyedut sukar. Pada kemuncak serangan, serangan jantung dan pernafasan adalah mungkin. Serangan berlangsung selama beberapa saat, selepas itu keadaan pesakit kelihatan bertambah baik. Selepas itu, serangan kekejangan otot laring dan pharynx boleh berlaku walaupun dari pergerakan udara (aerophobia), cahaya terang (photophobia) atau perkataan yang kuat (acousticophobia). Serangan itu disertai dengan pergolakan psikomotor, di mana pesakit berkelakuan seperti "orang gila". Kesedaran menjadi kabur semasa serangan, tetapi hilang dalam tempoh interiktal. Semasa tempoh pergolakan, disebabkan peningkatan nada sistem saraf simpatetik, pesakit mengalami peningkatan mendadak dalam air liur (sialorrhea) dengan ketidakupayaan untuk menelan air liur akibat kekejangan otot pharyngeal. Pesakit menyembur air liur. Sesetengah pesakit mungkin mengalami tanda-tanda meningisme dan juga opisthotonus, dan sawan adalah perkara biasa. Dalam kes ini, cecair serebrospinal mungkin tidak berubah, tetapi dalam sesetengah pesakit, kepekatan protein mungkin meningkat dan bilangan sel mungkin meningkat disebabkan oleh limfosit.
Tanpa rawatan yang mencukupi, tanda-tanda dehidrasi meningkat, ciri-ciri wajah menjadi lebih tajam, dan berat badan berkurangan. Suhu badan meningkat kepada nilai yang tinggi. Kejang boleh berlaku. Tempoh peringkat pengujaan adalah kira-kira 2-3 hari, jarang 4-5 hari. Hasil maut biasanya berlaku semasa salah satu serangan. Jarang sekali, pesakit bertahan hingga ke peringkat ketiga penyakit ini.
Semasa tempoh lumpuh, pesakit menjadi tenang. Serangan hidrofobia berhenti, pesakit boleh minum dan menelan makanan, kesedaran adalah jelas. Walau bagaimanapun, walaupun kesejahteraan yang jelas, kelesuan, sikap tidak peduli, peningkatan kemurungan, kelumpuhan anggota badan, gangguan pelvis, kelumpuhan saraf kranial tidak lama lagi muncul. Suhu badan meningkat kepada 42-43 °C, tekanan arteri menurun, dan menjelang akhir hari pertama kematian berlaku akibat lumpuh pusat kardiovaskular dan pernafasan.
Leukositosis neutrofilik, peningkatan hemoglobin, eritrosit, dan hematokrit diperhatikan dalam darah periferi.
Apa yang mengganggumu?
Borang
Secara klinikal, bentuk tipikal dan atipikal dibezakan. Bentuk atipikal termasuk semua kes tanpa rangsangan dan hidrofobia. Bentuk atipikal termasuk bulbar, cerebellar, meningoencephalitic, dll.
Diagnostik rabies
Pengesanan antigen rabies, antibodi, RNA virus, atau pengasingan virus membolehkan diagnosis rabies. Oleh kerana sebarang ujian individu mungkin negatif pada pesakit dengan rabies, sampel serum bersiri untuk pengesanan antibodi rabies, sampel air liur untuk kultur virus, dan biopsi kulit untuk ujian imunofluoresensi langsung untuk antigen virus kadangkala diperlukan, terutamanya apabila rabies sangat disyaki.
Salah satu kaedah yang paling cepat untuk mendiagnosis rabies antemortem pada manusia adalah dengan melakukan ujian imunofluoresensi langsung pada biopsi kulit tengkuk untuk mengesan antigen rabies. Ujian imunofluoresensi langsung ialah kaedah yang paling sensitif dan khusus untuk mengesan antigen rabies dalam kulit dan tisu segar lain (cth, biopsi otak), walaupun kadangkala keputusan mungkin negatif pada awal penyakit. Jika tisu segar tidak tersedia, pencernaan enzimatik tisu tetap boleh meningkatkan kereaktifan ujian imunofluoresensi; walau bagaimanapun, sensitiviti mungkin sangat rendah.
Diagnosis juga boleh ditubuhkan jika virus diasingkan daripada air liur selepas inokulasi sel neuroblastoma atau tikus makmal; ini biasanya paling berkesan semasa 2-3 minggu pertama penyakit. Pengesanan antibodi peneutral virus rabies, biasanya dilakukan oleh ujian perencatan fokus pendarfluor pesat (RFFIT), dalam serum individu yang tidak divaksinasi juga adalah diagnostik. Kehadiran antibodi dalam cecair serebrospinal mengesahkan diagnosis, tetapi ia mungkin muncul 2-3 hari kemudian daripada antibodi serum dan oleh itu mungkin kurang berguna pada peringkat awal penyakit. Walaupun tindak balas serologi selepas vaksinasi secara amnya tidak dapat dibezakan daripada tindak balas serologi yang disebabkan oleh penyakit, vaksinasi biasanya tidak menghasilkan antibodi kepada cecair serebrospinal.
Hanya tujuh kes "pemulihan" rabies dalam tempoh 25 tahun yang lalu telah didokumenkan dengan baik. Walaupun virus rabies tidak diasingkan daripada mana-mana pesakit, titer tinggi antibodi peneutralan rabies dalam sampel serum dan kehadiran antibodi peneutralan dalam cecair serebrospinal sangat menyokong diagnosis.
Apa yang perlu diperiksa?
Ujian apa yang diperlukan?
Diagnosis pembezaan
Diagnosis rabies manusia biasanya dibuat berdasarkan data epidemiologi dan klinikal dan disahkan di makmal. Diagnosis adalah mudah jika terdapat sejarah gigitan haiwan dan spektrum penuh gejala dan tanda telah berlaku. Jika tidak, penilaian yang teliti tetapi pantas terhadap ciri epidemiologi dan klinikal bagi kes yang kurang tipikal adalah perlu sebelum melakukan ujian makmal khusus. Mana-mana pesakit yang mempunyai tanda atau gejala neurologi atau ensefalitis yang tidak dapat dijelaskan harus disoal tentang kemungkinan terdedah kepada haiwan di kawasan endemik rabies di dalam atau di luar negara kediaman. Kegagalan untuk mengesyaki rabies dalam beberapa kematian manusia baru-baru ini di Amerika Syarikat mungkin disebabkan oleh kekurangan sejarah pendedahan yang teliti.
Pada permulaan penyakit, rabies boleh meniru banyak penyakit berjangkit dan tidak berjangkit. Banyak ensefalitida lain, seperti yang disebabkan oleh herpesvirus dan arbovirus, menyerupai rabies. Penyakit berjangkit lain juga boleh meniru rabies, seperti tetanus, malaria serebrum, rickettsiosis, dan demam kepialu. Penyakit berjangkit lumpuh yang boleh dikelirukan dengan rabies termasuk poliomielitis, botulisme, dan ensefalitis herpes simian B.
Penyakit tidak berjangkit yang mungkin dikelirukan dengan rabies termasuk beberapa sindrom neurologi, terutamanya polineuropati radang akut (sindrom Guillain-Barré), serta encephalomyelitis selepas vaksinasi alahan akibat vaksinasi rabies pada tisu saraf, keracunan atau mabuk dadah, penarikan alkohol, porfiria akut dan rabies. Sindrom Guillain-Barré mungkin disalah anggap sebagai rabies lumpuh, dan sebaliknya.
Siapa yang hendak dihubungi?
Rawatan rabies
Rawatan untuk rabies belum dibangunkan. Pentadbiran dos besar imunoglobulin anti-rabies khusus dan interferon leukosit adalah tidak berkesan. Rawatan simtomatik diberikan untuk mengurangkan penderitaan pesakit. Untuk tujuan ini, pesakit diletakkan di dalam wad atau kotak yang berasingan, rejim perlindungan dicipta yang mengehadkan pengaruh persekitaran luaran (mengurangkan bunyi bising, cahaya terang, aliran udara). Untuk mengurangkan keseronokan sistem saraf pusat, pil tidur, antikonvulsan, dan ubat penahan sakit ditetapkan. Imbangan air dinormalisasi.
Pada peringkat lumpuh, ubat-ubatan ditetapkan yang merangsang aktiviti sistem kardiovaskular dan pernafasan. Adalah disyorkan untuk menggunakan pengoksigenan hiperbarik, hipotermia serebrum, pernafasan mekanikal terkawal dengan curarization lengkap pesakit. Walau bagaimanapun, semua kaedah rawatan boleh dikatakan tidak berkesan. Dalam kes terbaik, adalah mungkin untuk memanjangkan hayat pesakit selama beberapa bulan. Hasil yang tidak menguntungkan ditentukan oleh keparahan kerosakan pada batang otak dengan pemusnahan pusat penting.
Pencegahan
Pembangunan vaksin rabies pertama oleh Pasteur pada tahun 1885 membawa kepada era kawalan rabies yang lebih berkesan. Hari ini, walaupun kadar kematian hampir 100% pada manusia akibat rabies, penyakit ini boleh dicegah sepenuhnya melalui vaksinasi sebelum dan/atau selepas pendedahan. Semasa Pasteur dan rakan-rakannya memulakan vaksinasi anjing persendirian di Paris, vaksinasi besar-besaran pertama terhadap anjing telah dijalankan pada awal 1920-an di Jepun, menandakan program kawalan rabies kebangsaan yang pertama. Pemvaksinan mulut haiwan liar, yang pertama kali dibangunkan pada tahun 1970-an, telah berulang kali ditunjukkan untuk mengawal penyakit ini dengan berkesan dalam perumah daratan utama seperti musang, rakun dan sigung.[ 68 ] Pemvaksinan rabies yang berterusan terhadap populasi haiwan takungan pada 70% atau kadar liputan yang lebih tinggi akhirnya akan menghapuskan spesies perumah RABV dan dari reservoir reservoir akhirnya akan menghapuskan spesies RABV dari reservoir. [ 69 ]
Data filogenetik menunjukkan bahawa lyssavirus menjangkiti kelawar lama sebelum mereka menjangkiti mamalia darat, dan kebanyakan lyssavirus, termasuk RABV, masih beredar dalam pelbagai spesies kelawar di seluruh dunia.[ 70 ] Walau bagaimanapun, kaedah berkesan untuk mencegah penularan RABV di kalangan kelawar masih sukar difahami, menghalang kemungkinan pembasmian rabies sepenuhnya pada masa ini. Walau bagaimanapun, walaupun selepas terdedah kepada RABV melalui gigitan mamalia yang dijangkiti rabies, profilaksis selepas pendedahan yang selamat dan berkesan (PEP, termasuk pembersihan luka, globulin imun rabies dan vaksinasi rabies) boleh melindungi manusia daripada jangkitan rabies jika rawatan diberikan dengan segera dan mengikut cadangan Pertubuhan Kesihatan Sedunia (WHO).
Kedua-dua kaedah mencegah kematian manusia ini—satu berdasarkan pemvaksinan orang yang terdedah dan satu lagi berdasarkan pemvaksinan anjing yang mencukupi untuk memutuskan kitaran penularan di sumbernya—adalah bahan binaan pendekatan "satu kesihatan" untuk pencegahan dan kawalan rabies anjing. Dua cara berbeza untuk mencegah kematian manusia ini dianggap sebagai alternatif yang berasingan: Strategi A, berdasarkan penyediaan PEP kepada orang ramai, dan Strategi B, berdasarkan vaksinasi anjing; atau sebagai komponen gabungan Strategi A + B dalam analisis kemungkinan kos strategi alternatif.[ 71 ]
Negara-negara seperti Thailand telah mencapai kejayaan besar dalam mencegah kematian manusia melalui penggunaan PEP, tetapi juga mendapati peningkatan permintaan dan kos yang berkaitan dengan penggunaan PEP sahaja. [ 72 ] Sebagai contoh, berbanding situasi pada tahun 1991, empat kali lebih ramai orang (lebih daripada 400,000) memerlukan PEP pada tahun 2003. Data terkini menunjukkan bahawa Republik Rakyat China, yang memberi vaksin kepada 15 juta orang setahun selepas potensi pendedahan rabies, membelanjakan kira-kira AS$650 juta setahun untuk PEP sahaja. [ 73 ]
Pendekatan yang lebih mampan adalah untuk mencegah penyebaran jangkitan pada sumber, dalam populasi haiwan, sambil meningkatkan akses kepada PEP untuk pesakit manusia yang terdedah apabila diperlukan. Jika ada kemahuan politik dan pembiayaan yang mencukupi untuk mengawal rabies anjing, kematian boleh dan telah dihapuskan. Penggunaan vaksinasi anjing secara meluas telah membawa kepada penghapusan rabies anjing dari beberapa negara, termasuk Malaysia pada tahun 1954, [ 74 ] Jepun pada tahun 1956, Taiwan pada tahun 1961, Singapura, dan, khususnya, di seluruh Eropah Barat (disemak dalam Rupprecht et al, King et al, dan Gongal dan Wright). [ 75 ]
Использованная литература


 [
[